Quimica: Ciencia que se encarga de estudiar la materia y la energía, así como todas las transformaciones que estas sufren.
1. ¿Cuáles son las características específicas de la materia?
2. ¿Cuáles son las propiedades de la materia?
3. Escribe un ejemplo de propiedad extensiva y de propiedad intensiva.
4. ¿Qué es la energía?
5. ¿Qué es la energía cinética?
6. ¿Qué es la energía potencial?
7. Menciona tres tipos de energía, sus ventajas y desventajas.
8. Menciona dos tipos de energías limpias y explica ¿por qué se les considera así?
9. ¿Cuál es la ley de la conservación de la energía?
10. ¿Hay diferencia entre calor y temperatura?
11. ¿Qué es materia?
12. ¿Cuáles son los estados de agregación de la materia?
13. ¿Cuál es el ordenamiento de las partículas en los diferentes estados de agregación?
14. ¿Cuál es la clasificación de la materia?
15. ¿Cuáles son los cambios que puede presentar la materia?
16. ¿Cuál es la teoría cinético-molecular de la materia?
17. ¿Qué es un elemento?
18. ¿Qué es un compuesto?
19. ¿Qué es una mezcla?
20. ¿Qué es una sustancia?
21. Menciona y describe los tipos de mezclas.
22. ¿Qué es el método científico y para qué sirve?
23. Menciona los pasos del método científico.
24. Describe 3 medidas de seguridad necesarias para el trabajo experimental en laboratorio.
25. ¿Por qué es importante la cuantificación en la química?
26. ¿Qué sistema de unidades se utiliza en la medición de propiedades químicas?
27. ¿Cuáles fueron las primeras explicaciones sobre los átmos que se dieron en Grecia y quiénes las hicieron?
28. ¿Qué experimentó Dalton para concluir en su teoría atómica y cuál fue el modelo de átomo que realizó?
29. ¿En qué consistía el modelo atómico de Thomson?
30. ¿Qué experimentos realizó Rutherford y cuál fue su modelo atómico?
31. Explica el modelo atómico de Bohr.
32. ¿Qué es un átomo y en qué se divide?
martes, 17 de septiembre de 2013
Videos sobre Modelos atómicos
A continuación encontrarán unos videos que complementan el tema visto en la secuencia didáctica 5 "Teoría atómica y modelos atómicos"
TEORÍA ATÓMICA
MODELOS ATÓMICOS
Teoría atómica y modelos atómicos
Desde la Antigüedad, el ser humano se ha cuestionado de qué
estaba hecha la materia.
Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles.
Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración.
Muchos filósofos clásicos griegos consideraban absurda esta teoría atómica y la rechazaban; entre ellos tenemos a Empédocles,
contemporáneo de Demócrito, quien sostenía que todos los materiales
están compuestos por cuatro “elementos” : tierra, aire, fuego y agua;
Aristóteles (300 años a.c.), discípulo de Empédocles, describió los 4
elementos como la combinación de propiedades fundamentales de la
materia: sequedad, humedad, calor y frio, así:

Las doctrinas del atomismo se perpetuaron por medio del poema De Rerum Natura, escrito alrededor del año 50 a.c. por el poeta romano Lucrecio.
Unos veinte siglos después (1661), el físico y químico ingles Robert Boyle en su libro “el Químico Escéptico”, acepto la existencia del átomo; Isaac Newton, en su obra “Principia” (1867) y “Ópita” (1704), también acepto la teoría atomista de la materia.
A continuación estudiaremos diferentes hechos experimentales que motivaron la formulación de diferentes modelos atómicos por parte de los científicos en su intento de explicar la naturaleza y composición de la materia.
| Año | Científico | Descubrimientos experimentales | Modelo atómico | ||||||
| 1808 |  John Dalton |
|
|
||||||
| 1897 |  J.J. Thomson |
|
|
||||||
| 1911 |  E. Rutherford |
|
|
||||||
| 1913 |  Niels Bohr |
|
| ||||||
Características y manifestaciones de la energía
Llamamos energía a la capacidad que tiene un cuerpo para producir un trabajo o provocar un cambio. Sin energía no habría Sol, ni plantas, ni animales, nada…, ni sería posible la vida.
FORMAS DE ENERGÍALa energía se nos puede presentar de muchas formas, y algunas de las más importantes son:

 La energía eléctrica, gracias a la cual existe la corriente eléctrica y funcionan muchos de los aparatos que conocemos.
La energía eléctrica, gracias a la cual existe la corriente eléctrica y funcionan muchos de los aparatos que conocemos. 
 La energía calorífica, que es la que se transmiten dos cuerpos que están a diferentes temperaturas: el caliente al frío.
La energía calorífica, que es la que se transmiten dos cuerpos que están a diferentes temperaturas: el caliente al frío.  La energía eólica, que es la energía del viento.
La energía eólica, que es la energía del viento.  La energía solar, que es la energía de la luz del Sol.
La energía solar, que es la energía de la luz del Sol.  La energía nuclear, que se obtiene en las centrales nucleares, a partir del uranio y otras sustancias radiactivas.
La energía nuclear, que se obtiene en las centrales nucleares, a partir del uranio y otras sustancias radiactivas.  El sonido, que es una energía de vibración.
El sonido, que es una energía de vibración. 
Geotérmica

Maremotriz

Biomasa
 Biocombustibles
Biocombustibles
FORMAS DE ENERGÍALa energía se nos puede presentar de muchas formas, y algunas de las más importantes son:
La energía cinética, que es la que tiene un cuerpo que se halla en movimiento, por ejemplo, un coche circulando por una carretera.
La energía cinética
Este automóvil, con el que se realizan pruebas especiales a gran velocidad, posee una gran energía cinética.
La energía cinética
Este automóvil, con el que se realizan pruebas especiales a gran velocidad, posee una gran energía cinética.

La energía potencial gravitatoria,
que es la que tiene un cuerpo que está a cierta altura sobre la
superficie de la Tierra. Por ejemplo, una maceta en el balcón de un
tercer piso tiene más energía potencial que la misma maceta en el balcón
del primero. La suma de la energía cinética y la energía potencial se
llama energía mecánica.
 La energía eléctrica, gracias a la cual existe la corriente eléctrica y funcionan muchos de los aparatos que conocemos.
La energía eléctrica, gracias a la cual existe la corriente eléctrica y funcionan muchos de los aparatos que conocemos. 
La energía química, que es la que almacenan los alimentos, las pilas o los combustibles.
 La energía calorífica, que es la que se transmiten dos cuerpos que están a diferentes temperaturas: el caliente al frío.
La energía calorífica, que es la que se transmiten dos cuerpos que están a diferentes temperaturas: el caliente al frío.  La energía eólica, que es la energía del viento.
La energía eólica, que es la energía del viento.  La energía solar, que es la energía de la luz del Sol.
La energía solar, que es la energía de la luz del Sol.  La energía nuclear, que se obtiene en las centrales nucleares, a partir del uranio y otras sustancias radiactivas.
La energía nuclear, que se obtiene en las centrales nucleares, a partir del uranio y otras sustancias radiactivas.  El sonido, que es una energía de vibración.
El sonido, que es una energía de vibración. 
Geotérmica
Esta corresponde a la energía que puede ser obtenida en base al
aprovechamiento del calor interior de la tierra, este calor se debe a
varios factores entre los mas importantes se encuentran el gradiente
geotérmico, el calor radiogénico, etc. Geotérmico viene del griego geo, “Tierra”, y thermos, “calor”; literalmente “calor de la Tierra”.

Maremotriz
Es la resultante del aprovechamiento de las mareas, se debe a
la diferencia de altura media de los mares según la posición relativa de
la Tierra y la Luna y que como resultante da la atracción gravitatoria
de esta ultima y del sol sobre los océanos.
De esta diferencias de altura se puede obtener energía interponiendo
partes móviles al movimiento natural de ascenso o descenso de las
aguas, junto con mecanismos de canalización y depósito, para obtener
movimiento en un eje.

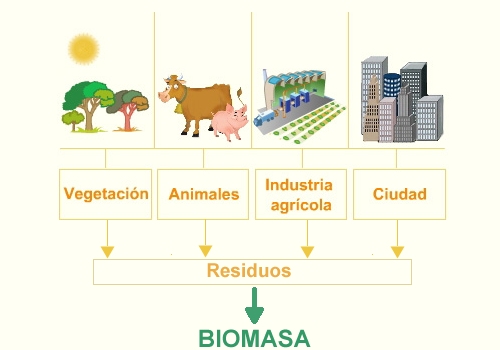
Biomasa
Es la que se obtiene de los compuestos orgánicos mediante procesos naturales. Con el término biomasa
se alude a la energía solar, convertida en materia orgánica por la
vegetación, que se puede recuperar por combustión directa o
transformando esa materia en otros combustibles, como alcohol, metanol o
aceite. También se puede obtener biogás, de composición parecida al gas
natural, a partir de desechos orgánicos.

Son fuente renovable de energía con un gran potencial para impulsar el desarrollo sustentable.
Son combustibles de origen biológico obtenidos de manera renovable a partir de restos orgánicos.Constituyen la primera fuente de energía que conoció la humanidad.
Provienen de cultivos como caña de azúcar, maíz, sorgo, yuca y otros, usada para producir etanol, y los aceites provenientes de palma africana, soya, higuerilla, Jatropha curcas, colza y otras plantas, utilizados para producir biodiésel.
Son combustibles de origen biológico obtenidos de manera renovable a partir de restos orgánicos.Constituyen la primera fuente de energía que conoció la humanidad.
Provienen de cultivos como caña de azúcar, maíz, sorgo, yuca y otros, usada para producir etanol, y los aceites provenientes de palma africana, soya, higuerilla, Jatropha curcas, colza y otras plantas, utilizados para producir biodiésel.
sábado, 7 de septiembre de 2013
Videos sobre Materia
Video sobre la estructura interna de la materia.
Propiedades generales y específicas de la materia
Estados de agregación de la materia
Cambios de estado de la materia
Cambios Fisicos, Químicos y Nucleares de la materia
Cambios de la materia
Cuando una sustancia cambia, alguna forma de energía interviene. Un cambio es una conversión de la materia, de una forma distinta, debido a su interacción con la energía.

2. Cambios Químicos
Estos conllevan una variación en la composición de la naturaleza de la materia, es decir a partir de una porción de material llamada reactivo, se obtiene un material distinto denominado Producto, por medio de una reacción de una reacción química y en la cual pueden influir diversos factores tales como la luz, presión, u otras sustancias reactivas. La formación del oxido de hierro sobre la barra de metal constituye un caso de cambio químico, puesto que el oxido de hierro (producto) no es el mismo que el hierro puro (reactivo).
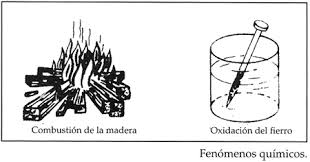
 La radiactividad es el resultado de un cambio nuclear.
Todos los núcleos de los elementos químicos tienen
una estructura específica y generalmente estable cuando es
igual el número de protones (partículas con carga
positiva) y neutrones (partículas sin carga), pero a medida
que se incrementa el tamaño y peso del núcleo, se
provoca una inestabilidad en él, debido a las fuerzas de
repulsión de los protones, lo que da origen a la radiactividad.
Ésta se presenta de tres maneras, como emisión de
partículas alfa (D), beta (E) y emisión de radiaciones
gama (J).
La radiactividad es el resultado de un cambio nuclear.
Todos los núcleos de los elementos químicos tienen
una estructura específica y generalmente estable cuando es
igual el número de protones (partículas con carga
positiva) y neutrones (partículas sin carga), pero a medida
que se incrementa el tamaño y peso del núcleo, se
provoca una inestabilidad en él, debido a las fuerzas de
repulsión de los protones, lo que da origen a la radiactividad.
Ésta se presenta de tres maneras, como emisión de
partículas alfa (D), beta (E) y emisión de radiaciones
gama (J).
 Además de la radiactividad, existen otros tipos de cambios
nucleares: la fisión y la fusión nuclear. La fisión
consiste en la separación o rompimiento de un núcleo
pesado para formar dos núcleos más ligeros. La fusión
nuclear es el proceso inverso ya que consiste en obtener un
núcleo más pesado a partir de la unión de dos
ligeros. En ambos casos, para iniciar el proceso se requiere gran
cantidad de energía, pero la cantidad de energía que
se libera es mucho mayor.
Además de la radiactividad, existen otros tipos de cambios
nucleares: la fisión y la fusión nuclear. La fisión
consiste en la separación o rompimiento de un núcleo
pesado para formar dos núcleos más ligeros. La fusión
nuclear es el proceso inverso ya que consiste en obtener un
núcleo más pesado a partir de la unión de dos
ligeros. En ambos casos, para iniciar el proceso se requiere gran
cantidad de energía, pero la cantidad de energía que
se libera es mucho mayor.
A los cambios que sufre la materia se les conoce como fenómenos y pueden ser: Físicos, Químicos o Nucleares.
1. Cambios Físicos
Pueden definirse como aquellos cambios que sufre la materia en su forma,
en su volumen o en su estado, sin alterar su composición o naturaleza.
Así, si se calienta un bloque de hielo a determinada temperatura, este
se licua, es decir, pasa al estado solido al liquido modificando su
forma y volumen pero conservando su naturaleza, pues antes del cambio se
tenia agua solida y después del cambio se tiene agua liquida; pero si
se continua el calentamiento, finalmente se alcanzará la temperatura de
ebullición y el agua pasa al estado de vapor conservándose inalterable
en todos los casos, la composición de ésta.

2. Cambios Químicos
Estos conllevan una variación en la composición de la naturaleza de la materia, es decir a partir de una porción de material llamada reactivo, se obtiene un material distinto denominado Producto, por medio de una reacción de una reacción química y en la cual pueden influir diversos factores tales como la luz, presión, u otras sustancias reactivas. La formación del oxido de hierro sobre la barra de metal constituye un caso de cambio químico, puesto que el oxido de hierro (producto) no es el mismo que el hierro puro (reactivo).
3. Cambios Nucleares
Un cambio nuclear consiste en la modificación del
número de partículas (protones y neutrones) de los
núcleos que forman los átomos de los elementos químicos.
Cuando se presenta un cambio de este tipo, existen grandes cantidades
de energía asociadas a él, debido a que son muy grandes
las fuerzas que mantienen unidas las partículas en los núcleos.
La radiactividad puede utilizarse para establecer la edad de fósiles
o restos arqueológicos, ya que existen detectores sumamente
sensibles que pueden medir los cambios nucleares presentados en
la estructura original de los objetos. La medicina nuclear utiliza
compuestos radiactivos como marcadores con propósitos de
diagnóstico o para el tratamiento de enfermedades.
Cambios de estado de la materia
 Cambio de
estado es el proceso mediante el cual las sustancias pasan de un estado de
agregación a otro. El estado físico depende de las fuerzas de cohesión que
mantienen unidas a las partículas. La modificación de la
temperatura o de la
presión modificará dichas fuerzas de cohesión pudiendo provocar un cambio de
estado.
Cambio de
estado es el proceso mediante el cual las sustancias pasan de un estado de
agregación a otro. El estado físico depende de las fuerzas de cohesión que
mantienen unidas a las partículas. La modificación de la
temperatura o de la
presión modificará dichas fuerzas de cohesión pudiendo provocar un cambio de
estado.
El paso
de un estado de agregación más ordenado a otro más desordenado (donde las
partículas se mueven con más libertad entre sí) se denomina cambio de estado
progresivo. Cambios de estado progresivos son:
- El paso de sólido a líquido que se llama fusión. Ejemplo el hielo a agua líquida se funde.
- El paso de líquido a gas que se llama vaporización. Ejemplo el agua líquida pasa a vapor de agua: evaporándose lentamente (secándose un recipiente o una superficie con agua) o al entrar en ebullición el líquido (hierve).
- El paso de sólido a gas que se llama sublimación. Ejemplo el azufre o el yodo sólidos al calentarlos pasan directamente a gas.
El paso de un estado de agregación más desordenado a otro más ordenado se denomina cambio de estado regresivo. Cambios de estado regresivos son:
- El paso de gas a líquido que se llama condensación. Ejemplo en los días fríos de invierno el vapor de agua de la atmósfera se condensa en los cristales de la ventana que se encuentran fríos o en el espejo del cuarto de baño.
- El paso de líquido a sólido que se llama solidificación. Ejemplo el agua de una cubitera dentro del congelador se solidifica formando cubitos de hielo.
- El paso de gas a sólido que se denomina solidificación regresiva.
Estados de agregación de la materia
Al hablar de estados de agregación nos referimos a la manera en que las partículas que constituyen la materia se unen o se agregan unas a otras, así es como se forman los objetos que nos rodean. La unión puede presentarse de tres formas generales:
1. Muy unidas
2. A distancia media
3. Muy separadas
De esta manera, la materia se presentará en 4 estados básicos.
Estado sólido
En el estado sólido, las partículas ya sean átomos o moléculas se encuentran muy unidos entre sí debido a las poderosas fuerzas de cohesión que hay entre ellas; aunque no dejan de moverse, pues poseen un movimiento de vibración. Por esta razón los sólidos presentan las siguientes propiedades:
- Tienen forma propia y volumen definido. Sus partículas se mantienen juntas con una disposición fija, ordenada y empaquetada que hace que los sólidos tengan forma y volumen constante
- No se comprimen, al aplicar una fuerza sobre un sólido, este no se comprime, porque sus partículas están muy cerca de otras. Si se les comprime, por lo general se deforman, pero el volumen del sólido no disminuye.

El Estado Líquido
En los líquidos, las partículas están juntas pero las atracciones
entre ellas no son tan grandes y se mueven con cierta libertad. Debido a
ello, los líquidos:
- Tienen forma variable, eso se debe a que las partículas se deslizan con facilidad para adoptar la forma del recipiente que las contiene.
- Tienen un volumen definido, al igual que en los sólidos las fuerzas de atracción entre sus moléculas son lo suficientemente altas como para impedir que los líquidos se compriman o se expandan.
- No se puede comprimir, su volumen no disminuye aunque se ejerza mucha presión sobre ellos. Las partículas están unidas, sin dejar espacio entre ellas, por eso no se pueden acercar mas.

- Fluyen, los líquidos fluyen, es decir se derraman por cualquier superficie, abertura o rendija que encuentren a su paso. Sus partículas tienen un movimiento tal que les permite deslizarse y resbalar una sobre otras.
No todos los líquidos fluyen con la misma facilidad. La viscosidad
de un líquido es la medida de resistencia al flujo. Así, los líquidos
viscosos como la miel, fluyen con lentitud; el agua y el alcohol, que
son poco viscosos fluyen mas rápido.
Estado gaseoso
La materia
en el estado gaseoso tiene la capacidad de ocupar todo el volumen que
lo posee. Cuando usted siente el viento que sopla en su cara, cuando
huele la fragancia de un perfume en una habitación, o cuando percibe un
olor fétido entonces usted está tomando contacto con la materia en estado gaseoso.
- El Cl2 se usa para purificar el agua potable
- El acetileno C2H2 se usa para soldar
- El cianuro de hidrógeno (CHN) que se usa en las cámaras de gas.
- El dióxido de carbono (CO2) y metano (CH4) como gases que producen el efecto invernadero.
- Los freones que son gases sintéticos, empleados en el comercio como refrigerantes.
El estado plasmático
 Los científicos consideran un cuarto estado de la materia: El estado plasmático. Se produce cuando la materia está sometida a temperaturas mayores a 10000°C, como la que se alcanza en el sol y en todas las estrellas.
Los científicos consideran un cuarto estado de la materia: El estado plasmático. Se produce cuando la materia está sometida a temperaturas mayores a 10000°C, como la que se alcanza en el sol y en todas las estrellas.
En esas condiciones, loas átomos pierden algunos de sus electrones,
convirtiéndose en iones. Así, la materia se convierte en un conjunto de
iones positivos y de electrones cargados negativamente, que se mueven
entre los iones sin estar ligados a ninguno de ellos.Propiedades de la materia
Una sustancia se identifica y distingue de otras por medio de sus propiedades o cualidades físicas y químicas. Las propiedades
son las diversas formas en que impresionan los cuerpos materiales a
nuestros sentidos o a los instrumentos de medida. Así podemos
diferenciar el agua del alcohol, el hierro del oro, azúcar de la sal,
etc.
Las propiedades de la materia se clasifican en dos grandes grupos: generales y especificas.
Son las propiedades que presenta todo cuerpo material sin excepción y al margen de su estado físico, así tenemos:
- Masa: Es la cantidad de materia contenida en un volumen cualquiera, la masa de un cuerpo es la misma en cualquier parte de la Tierra o en otro planeta.
- Volumen: Un cuerpo ocupa un lugar en el espacio
- Peso: Es la acción de la gravedad de la Tierra sobre los cuerpos. En los lugares donde la fuerza de gravedad es menor, por ejemplo, en una montaña o en la Luna, el peso de los cuerpos disminuye.
- Divisibilidad: Es la propiedad que tiene cualquier cuerpo de poder dividirse en pedazos más pequeños, hasta llegar a las moléculas y los átomos.
- Porosidad: Como los cuerpos están formados por partículas diminutas, éstas dejan entre sí espacios vacíos llamados poros.
- La inercia: Es una propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.
- La impenetrabilidad: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente.
- La movilidad: Es la capacidad que tiene un cuerpo de cambiar su posición como consecuencia de su interacción con otros.
- Elasticidad: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza. La elasticidad tiene un límite, si se sobrepasa el cuerpo sufre una deformación permanente o se rompe. Hay cuerpos especiales en los cuales se nota esta propiedad, como en una liga, en la hoja de un cuchillo; en otros, la elasticidad se manifiesta poco, como en el vidrio o en la porcelana.
Son las propiedades peculiares que caracterizan a cada sustancia, permiten su diferenciación con otra y su identificación.
Entre estas propiedades
tenemos: densidad, punto de ebullición, punto de fusión, índice de
refracción de luz, dureza, tenacidad, ductibilidad, maleabilidad,
solubilidad, reactividad, actividad óptica, energía de ionización,
electronegatividad, acidez, basicidad, calor latente de fusión, calor
latente de evaporización, etc.
Las propiedades especificas pueden ser químicas o físicas dependiendo si se manifiestan con o sin alteración en su composición interna o molecular.
A) Propiedades Físicas: Son aquellas propiedades que impresionan nuestros sentidos sin alterar su composición interna o molecular.
Ejemplos: densidad, estado físico (solido, liquido, gaseoso), propiedades organolépticas
(color, olor, sabor), temperatura de ebullición, punto de fusion,
solubilidad, dureza, conductividad eléctrica, conductividad calorífica,
calor latente de fusión, etc.
- Propiedades Extensivas: el valor medido de estas propiedades depende de la masa. Por ejemplo: inercia, peso, área, volumen, presión de gas, calor ganado y perdido, etc.
- Propiedades Intensivas: el valor medido de estas propiedades no depende de la masa. Por ejemplo: densidad, temperatura de ebullición, color, olor, sabor, calor latente de fusión, reactividad, energía de ionización, electronegatividad, molécula gramo, átomo gramo, equivalente gramo, etc.
B) Propiedades Químicas:
son aquellas propiedades que se manifiestan al alterar su estructura
interna o molecular, cuando interactúan con otras sustancias.
Ejemplos: El Fe se oxida a temperatura ambiental y el Oro no se oxida; el CH4 es combustible y el CCl4 no es combustible; el Sodio reacciona violentamente con el agua fria para formar Hidróxido de Sodio y el Calcio reacciona muy lentamente con el agua para formar Hidróxido de Calcio; el alcohol es inflamable y el H2O no lo es; el acido sulfúrico quema la piel y el acido nítrico no, etc.
jueves, 5 de septiembre de 2013
Cuán lejos llegarás
Para quienes no conocen a Dr. Seuss, fue un genio y autor de muchos libros para niños, entre ellos "El gato en el sombrero" y "Huevos verdes con jamón". La mayoría de sus libros están traducidos al español y contienen lecciones para toda la vida. Esta obra fue la última que escribió antes de su muerte en el 2001. Lo comparto con ustedes, porque es un mensaje que quiero darles a ustedes y a mi misma. Saludos!
¡Oh, cuan lejos llegarás!
Hoy es tu día.
¡Grandes lugares visitarás!
¡Te alzarás y partirás!
Con cerebro en tu cabeza.
Con pies en tus zapatos.
Cualquier dirección escojerás
que tus pies quieran encontrar
Por tu cuenta andarás y bien lo sabes
Adónde ir eres tú quien decidirá.
Mirarás calle arriba y calle abajo.
Mirarás con cuidado.
Algunos te dirán "En esa dirección no escojas avanzar"
Pero con tu cabeza llena de cerebro
y tus zapatos llenos de pies,
tú eres demasiado listo para bajar
por ninguna calle no debas transitar.
Y puede que no encuentres ninguna por la que desees viajar.
En ese caso, por supuesto,
te dirigirás directamente fuera de la ciudad.
Al aire libre estupendo se está
Y hay mil cosas que pueden ocurrir y frecuentemente ocurren
a gente con tanto cerebro y tantos pies como tú.
Y cuando las cosas empiecen a ocurrir, no te preocupes. No te sulfures.
Sigue directamente adelante. Tú empezarás a ocurrir también.
¡Oh, cuan lejos llegarás!
¡Estarás en camino! ¡Estarás viendo grandes cosas!
Te unirás a personas ambiciosas
que a grandes alturas volarán.
No te quedarás atras,
porque tendrás la velocidad.
Pasarás a toda la pandilla
y pronto en cabeza irás.
Donde quiera que vueles,
serás el mejor de los mejores.
Donde quiera que vayas,
superarás a todos los demás.
Excepto cuando así no será.
Porque, algunas veces, no será.
Lamento decirlo así pero, tristemente,
la verdad es que Bang-ups y Hang-us pueden ocurrirte.
Puede quedarte colgado de una rama espinosa.
Y tu pandilla volando te pasará.
Plantado te quedarás.
Del plantón por fin saldrás,
con una fea magulladora que mostrar.
Y oportunidades habrá,
en que en una bajada caerás.
Cuando en la bajada estés,
divertida la cosa no la será
Y des-bajarte ardua empresa resultará.
A un lugar llegarás
donde las calles marcadas no están.
Algunas ventanas iluminadas verás
Pero sobre todo oscuras las encontrarás.
Un lugar en el que podrías torcerte a la vez el codo y la barbilla!
¿Te atreves a quedarte?
¿Te atreves a entrar?
¿Cuando pudes perder?
¿Cuanto puedes ganar?
Y si entras, ¿deberías girar a izquierda o derecha...
... o justo tres cuartos?
¿O tal vez no tanto?
¿O dar la vuelta y asomarte desde atrás?
Para ser un tipo de mente despierta,
me temo que descubrirás,
despertar su mente fácil no resultará.
Puedes acabar tan confundido
que empezarás a correr a toda prisa
por largas carreteras contoneantes a paso aterrador...
Y vagando durante millas
a través de salvajes páramos inexplorados,
irigiéndote, me temo,
hacia los lugares más inútiles.
El lugar de espera.
... para gente que solo espera.
Espera un tren que coger
o un autobús que llegará, o un avión al que subir
o el correo por venir, o la lluvia que caerá
o el teléfono que sonará, o la nieve que nevará
o espera alrededor de un Sí o No
o esperan a que le crezca el pelo.
Todo el mundo está simplemente esperando
Esperando a que el pez pique
o esperando al viento para una cometa volar
o esperando la noche del viernes
o esperando, quizás, a su tío Jake
o a que hierva una cazuela, o un Better Break
o un collar de perlas, o un par de pantalones
o una peluca de rizos, u Otra Oportunidad.
Todo el mundo espera sin más.
¡NO!
¡Eso no es para ti!
De algún modo escaparás
de toda esa espera y espera.
Encontrarás los lugares brillantes
donde está tocando la Boom Bands
con las banderas ondeando, una vez más.
¡Alto remontarás!
Listo para cualquier cosa bajo el cielo.
Listo porque tú eres ese tipo de tí@!
¡Oh, cuan lejos llegarás!
¡Que divertido será!
Hay puntos que anotar
Juegos que ganar.
Y las cosas mágicas que puedes hacer
con esa pelota que te harán el ganador/a más ganador/a de tod@s.
¡Fama!
Serás tan famos@ como famos@ se pueda ser,
con el mundo entero viendote ganar en la televisión...
Excepto cuando no lo hagan
Porque algunas veces, no lo hacen.
Me temo que algunas veces jugarás juegos solitarios también
Juegos que no puedes ganar
porque contra ti mismo jugarás.
Totalmente solo, te guste o no,
Sol@ será algo que te sentirás bastante
Y cuando solo estés,
hay muy buenas probabilidades de que encuentres cosas
que te asustarán hasta hacerte mear en los pantalones.
Hay cosas, carretera abajo entre la ceca y la meca,
que te asustarán tanto que no querrás seguir.
Pero seguirás aunque el clima sea apestoso.
Seguirás aunque tus enemigos te ronden.
Seguirás aunque el hakken-Kraks aulle.
Remontando un montón de riachuelos aterradores,
aunque los brazos puedan escocerte
y tus zapatos de lona empaparse.
Sin parar caminarás.
Y sabes que lejos llegarás y
encararás tus problemas sean cuales sean
Te enredarás, por supuesto, como ya sabes.
Te enredarás con muchas aves extrañas y seguirás.
Estate seguro cuando des un paso.
Pisa con cuidado y gran tacto
y recuerta esto:
La vida es un gran juego de equilibrio.
Nunca olvides ser diestro y hábil.
Y nunca enredes tu pie derecho con el izquierdo.
¿Y tendrás éxito?
¡Si! ¡Lo dentrás, sin duda!
(98 y tres cuarto por ciento garantizado)
¡Chic@, moverás montañas!
Así que, te llames Buxbaum,
o Bixby o Bray
o Mordecai Ali Van Allen O'Shea
¡a grande lugares llegarás!
¡Hoy es tu día!
Tu montaña te espera.
¡Así, que ponte en camino!
(texto traducido)
domingo, 1 de septiembre de 2013
El método científico
Los científicos emplean el método científico como una forma planificada
de trabajar. Sus logros son acumulativos y han llevado a la Humanidad
al momento cultural actual.
¡Sin Ciencia no hay Cultura!
Los hitos culturales van ligados a descubrimientos científicos:
Edad de piedra, bronce,... y espacial.
Aunque podemos decir que no hay un sólo
método científico o modelo clásico, algunos factores
son comunes a todos: una idea brillante del hombre, el trabajo complementario
de los científicos y de las ciencias, la verificabilidad, la
utilización de herramientas matemáticas, etc. También
son comunes los procedimientos descritos en este tema.
Método Científico
La palabra método se deriva de los vocablos griegos
metá “a lo largo” y odos
“camino”, la cual podemos entender
como:
La manera de ordenar una actividad hacia un fin
El orden sistemático que se impone
en la
investigación científica y nos conduce al conocimiento
El camino por el cual se
llega a cierto resultado en
la
actividad científica, cuando dicho camino no ha sido fijado por anticipado de manera deliberada y reflexiva
Es el conjunto de etapas que señalan la forma (procedimiento) para llevar a cabo una investigación cuyos resultados sean aceptados como válidos por
la comunidad científica.
Existen muchas variantes
del método científico, una de ellas es la siguiente:
1. Delimitar y definir
el objeto de la investigación o problema
2. Plantear la hipótesis de trabajo o el método de solución
al problema
3. Elaborar el diseño experimental, modelo o prototipo
4. Realizar experimentos, simulaciones, cálculos o pruebas
5. Analizar, verificar o validar
los resultados
6. En caso necesario reajustar el experimento, modelo o prototipo
y regresar al
paso 4
7. Obtener conclusiones
8. Contrastar las conclusiones con las predicciones
9. Sugerencias de trabajos futuros
10. Elaboración de un informe escrito
Características del Método Científico:
Es fáctico; se ciñe a los hechos
Se vale de la verificación empírica; exige una confrontación con la realidad
Es autocorrectivo; va rechazando o ajustando
sus propias conclusiones
Es progresivo; sus conclusiones no son infalibles ni finales
Ignora el hecho aislado;
sus formulaciones son de tipo general
Es didáctico,
permite plantear,
discutir y volver
a
plantear el
problema investigado
Es objetivo;
busca la verdad fáctica sin tomar en cuenta valores y creencias del científico.
Tanto en la investigación básica y aplicada como en el desarrollo tecnológico se aplica el método científico, en
cuanto a la formulación de
hipótesis, utilización de datos, aplicación de técnicas de cálculo y medición, búsqueda y verificación de conclusiones, etc.
Cuando un ingeniero,
un científico o un aficionado aplican el método científico y desarrollan nuevos conocimientos, están realizando una actividad de
investigación
científica.
Cuando un ingeniero,
un científico o un aficionado aplican el método científico y utilizan
conocimientos existentes para el desarrollo de productos y servicios, están realizando una actividad tecnológica.
Fuentes:
http://newton.cnice.mec.es/materiales_didacticos/mcientifico/
http://profesores.fi-b.unam.mx/jlfl/Seminario_IEE/Metodo_Cientifico.pdf
http://blog2008006879.wordpress.com/2013/01/21/metodo-cientifico/
Suscribirse a:
Entradas (Atom)








